En una serie de medidas publicadas en el Boletín Oficial, la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) dispuso prohibiciones y nuevas obligaciones destinadas a fortalecer el control sanitario de cosméticos y productos médicos en Argentina.

Se prohibieron jabones líquidos y se retirarón del mercado productos médicos por irregularidades
Anmat emitió cinco disposiciones que afectan a cosméticos y equipamiento médico en todo el país. Detectó productos sin inscripción, elaborados por empresas no habilitadas, material médico reprocesado y hasta la pérdida de una bomba de infusión de alto riesgo. También creó un nuevo sistema simplificado para fabricantes de bajo riesgo.

Las resoluciones apuntan a resguardar la salud pública frente a insumos ilegales o inseguros y, a la vez, a ordenar los procedimientos de habilitación de empresas del sector.
Prohíben jabones líquidos de las marcas SWELL y KEEPER
Las disposiciones 8789/2025 y 8780/2025 advierten sobre la circulación de jabones líquidos para manos sin autorización sanitaria, elaborados en establecimientos no habilitados y con rotulados que no coinciden con ningún producto inscripto oficialmente.
En el caso del “Jabón líquido para manos” marca SWELL, la ANMAT detectó su fabricación durante una inspección a la empresa Grupo Jac S.A., que no posee habilitación para elaborar cosméticos. Además, en los rótulos se consignaba un número de RNE y una denominación de “productos líquidos para higiene limpieza” que no están inscriptos en la base oficial.
La auditoría señaló que el establecimiento carece de dirección técnica habilitada, incumple la Resolución 155/98 —norma marco para cosméticos— y que el producto no cuenta con estudios que garanticen su seguridad, su composición química ni su calidad microbiológica. Por ese motivo, se ordenó prohibir su uso, venta, distribución y publicidad en todo el territorio nacional.

Una situación similar fue constatada con el “Jabón líquido KEEPER”, comercializado en bidones de 5 litros y diferentes fragancias. El producto se presentaba como elaborado por Keperchem SRL, pero la ANMAT verificó que esa firma no está habilitada como laboratorio cosmético y que en el domicilio declarado no existe ningún establecimiento autorizado.
Incluso, la empresa que sí operaba allí —KEEPERCHEM S.R.L.— había perdido su habilitación para producir artículos de uso doméstico en 2023.
De acuerdo con los anexos técnicos, el producto no tiene trazabilidad, no se conoce su composición real y carece de estudios de seguridad dermatológica. Por ello, se dispuso también la prohibición total de comercialización en todas sus variedades y lotes, y se notificó a las autoridades sanitarias de cada jurisdicción.
Retiran productos médicos reprocesados, una bomba de infusión extraviada y regulan un nuevo sistema para fabricantes
La Disposición 8774/2025 agrega un capítulo especialmente sensible: la detección de productos médicos vencidos que habían sido reprocesados irregularmente y puestos nuevamente en circulación.
Todo surgió durante una inspección en la firma Medical Element, en Paraná (Entre Ríos), habilitada solamente para el tránsito interjurisdiccional de dispositivos médicos sin cadena de frío. Allí se encontraron piezas de implantes cervicales en bolsas pouch, rotuladas como si hubieran sido esterilizadas por terceros y listas para su uso.

El análisis posterior reveló que los implantes no correspondían al acondicionamiento original del fabricante —CDH Prótesis e Implantes SRL— y que presentaban grabados con números de lote vencidos en 2024, pese a que la distribuidora los había enviado a “reprocesar” para extender artificialmente su vida útil.
Los cubos cervicales, clasificados como dispositivos de riesgo III, se emplean en cirugías de columna para otorgar estabilidad a segmentos vertebrales. Según el anexo técnico de la disposición, utilizar material adulterado podría implicar riesgos graves como infecciones, fallas en la fijación e incluso daño neurológico.
Por ello, la ANMAT resolvió prohibir el uso, venta y distribución de cualquier producto médico que declare “igb central de esterilización – MEDICAL ELEMENT” y ordenó instruir un sumario sanitario al responsable.
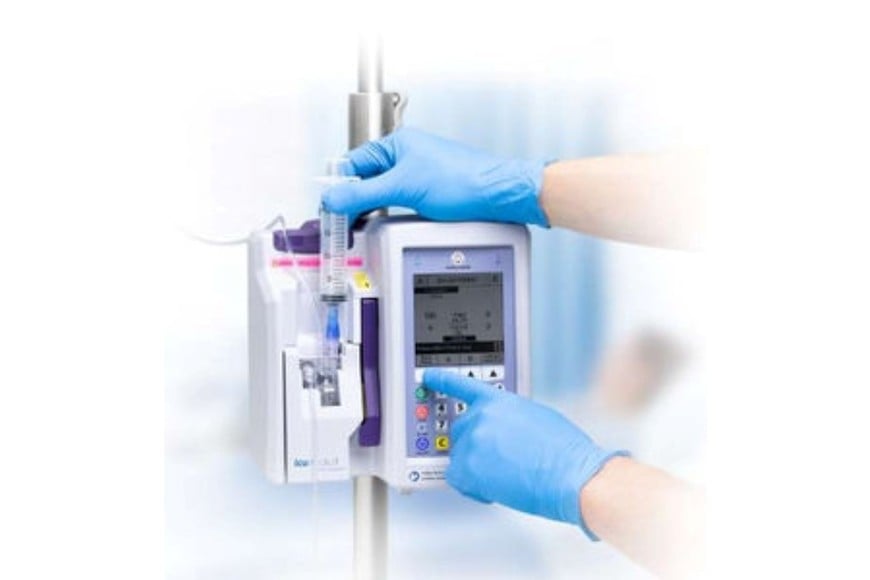
En paralelo, la Disposición 8775/2025 ordenó el retiro de una unidad de la “Bomba de infusión Plum™ A+” (serie 18304147), extraviada por la empresa titular, ICU Medical Argentina SRL.
Al tratarse de un equipo de riesgo elevado —utilizado para terapias parenterales, epidurales y administración de sangre— la ANMAT alertó que no se conoce el estado del dispositivo ni las condiciones en las que podría ser ofrecido. Por ese motivo, prohibió su uso y comercialización en todo el país.

Un nuevo régimen para fabricantes de productos médicos
En contraste con estas medidas de prohibición, la Disposición 8799/2025 introduce un cambio estructural orientado a simplificar trámites para empresas que elaboran o importan productos médicos de bajo riesgo.
La norma establece que fabricantes e importadores de dispositivos de clase I y II y de reactivos de diagnóstico clasificados como A o B podrán optar por un trámite simplificado, basado en la presentación de una declaración jurada digital, en lugar del proceso tradicional previsto por la Disposición 7425/13.
Según detalla el anexo, la declaración jurada deberá afirmar que la empresa cumple con las Buenas Prácticas de Fabricación vigentes, que posee instalaciones aptas, dirección técnica responsable y documentación respaldatoria disponible para inspección. La habilitación no tendrá plazo de vencimiento, pero cualquier modificación societaria, técnica o edilicia deberá informarse dentro de los 30 días.
No obstante, la ANMAT mantendrá la potestad de realizar inspecciones regulares, y el incumplimiento podrá derivar en sumarios, sanciones y suspensión de actividades, especialmente si la documentación declarada resulta falsa o incompleta.
El nuevo esquema busca agilizar procesos administrativos sin resignar controles, concentrando la fiscalización en los productos y actividades de mayor riesgo, que seguirán regidos por los procedimientos históricos.