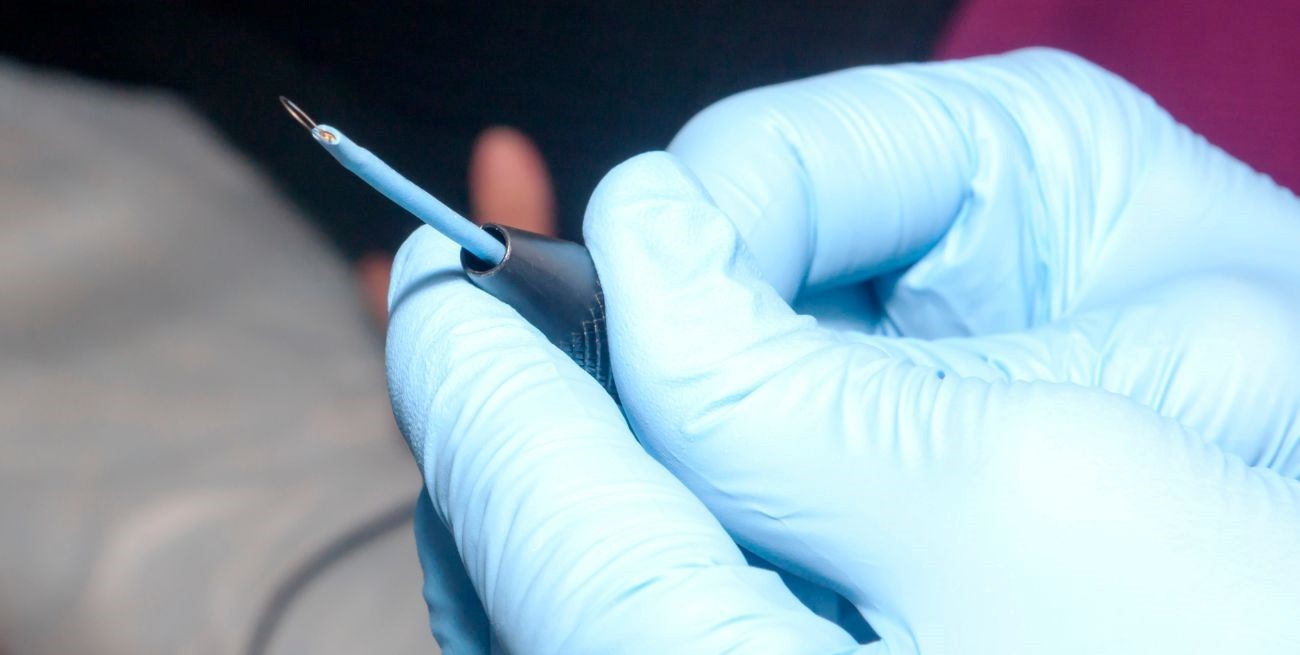
Un electrodo monopolar de inserción que se utilizaba para estudios cerebrales y que circulaba en el país sin autorización oficial fue prohibido por la Anmat. La medida, publicada en el Boletín Oficial, afecta a dos empresas del sector médico: una con sede en Córdoba y otra en la Ciudad de Buenos Aires.
Se prohibió el uso de un electrodo médico por una serie de irregularidades
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica detectó la comercialización de electrodos invasivos sin registro sanitario. Se trata de un insumo utilizado en estudios de actividad cerebral.

La disposición busca proteger la salud de los pacientes y garantizar la calidad de los insumos médicos que se utilizan en procedimientos altamente sensibles.
Sin control ni identificación
La disposición 4622/2025 de la Anmat, publicada el 3 de julio en el Boletín Oficial, resolvió la prohibición de uso, comercialización y distribución en todo el territorio argentino del producto denominado “Electrodos Monopolares de Inserción – ATI”.

La decisión se basa en que estos insumos no contaban con registro sanitario ni datos básicos de trazabilidad como número de lote, fecha de fabricación o vencimiento, y tampoco información del fabricante o importador en su envase.
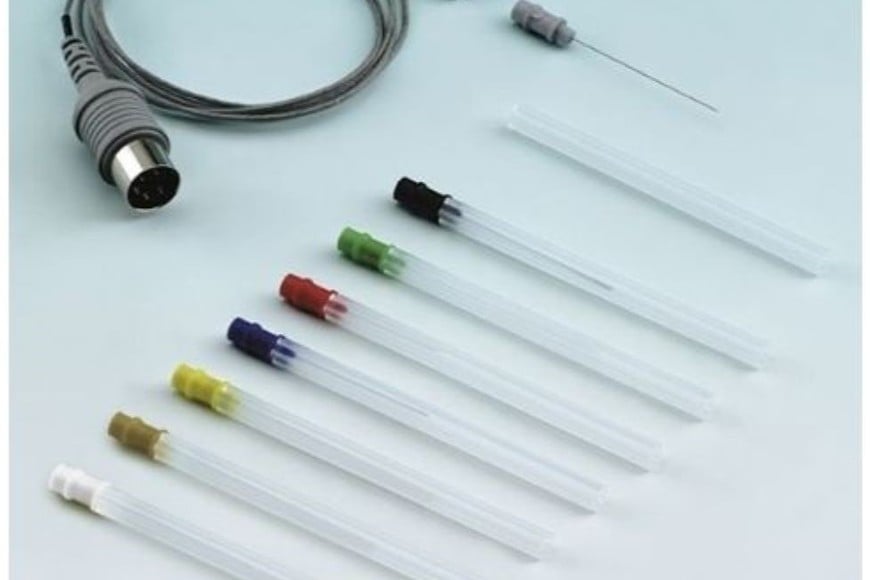
La irregularidad fue detectada el 27 de febrero de 2025, durante una inspección de rutina en la sede de la empresa Implantes Quirúrgicos S.A., ubicada en la ciudad de Córdoba. En el lugar se hallaron siete unidades del producto, cada una empacada en una bolsa plástica sin estuche ni identificación reglamentaria.
Consultada durante la inspección, la responsable de la empresa no pudo justificar el origen de los productos en ese momento y se comprometió a enviar la documentación por correo electrónico. Días más tarde, la firma remitió una factura emitida por la empresa Advantek S.R.L., con sede en la Ciudad Autónoma de Buenos Aires, lo que motivó una nueva inspección a esa firma.
Un insumo sin autorización
La ANMAT se presentó el 7 de marzo en la sede de Advantek S.R.L., empresa que cuenta con habilitación vigente como fabricante e importadora de productos médicos. Allí, los inspectores mostraron el electrodo extraído como muestra en la inspección anterior.
El representante de la firma explicó que ese producto no estaba incluido en el registro oficial de la empresa, y que se fabricaba esporádicamente como un insumo para electroencefalógrafos utilizados en estudios para determinar muerte cerebral.
A pesar de reconocer la fabricación y comercialización de los electrodos, Advantek admitió que los vendía sin etiquetado reglamentario ni fecha de vencimiento, embalados únicamente en bolsas tipo “pouch”. También confirmó la validez de la factura emitida en junio de 2022 a Implantes Quirúrgicos S.A., lo que probó que la operación fue efectivamente realizada.
Según la normativa vigente, los productos médicos sin autorización sanitaria son considerados ilegítimos, ya que no puede garantizarse ni su seguridad ni su eficacia.

La Anmat destacó que existen productos similares debidamente registrados, clasificados como clase de riesgo IV, que son utilizados para registrar la actividad eléctrica del cerebro y localizar focos epileptógenos con fines diagnósticos y terapéuticos. Sin embargo, el electrodo bajo análisis no contaba con dicha habilitación ni supervisión técnica.
Sanciones y sumarios por incumplimientos graves
Como consecuencia de lo detectado, la organización resolvió iniciar sumarios sanitarios a ambas firmas involucradas. Advantek S.R.L. fue señalada por incumplir el artículo 19 de la Ley 16.463, que prohíbe la elaboración y distribución de productos médicos ilegítimos, así como por violar la Disposición 64/2025, que regula la autorización de estos productos.
Por su parte, Implantes Quirúrgicos S.A. también fue imputada por adquirir y almacenar insumos sin verificar su habilitación sanitaria, en infracción al artículo 12 de la Disposición 6052/2013.
La disposición firmada por la administradora nacional de la Anmat, Nélida Agustina Bisio, establece que la prohibición permanecerá vigente hasta tanto el producto obtenga su correspondiente autorización sanitaria.
Además, se ordenó comunicar la medida al Ministerio de Salud de Córdoba, a las autoridades sanitarias provinciales y de la Ciudad Autónoma de Buenos Aires, así como a las dependencias internas competentes.
La medida apunta a prevenir posibles riesgos en la salud de los pacientes y a reforzar los mecanismos de control sobre el mercado de productos médicos, especialmente aquellos que se emplean en procedimientos invasivos o en contextos clínicos críticos.














Dejanos tu comentario
Los comentarios realizados son de exclusiva responsabilidad de sus autores y las consecuencias derivadas de ellos pueden ser pasibles de las sanciones legales que correspondan. Evitar comentarios ofensivos o que no respondan al tema abordado en la información.